I - Réaction acido-basique
1) Couple acide base
Un acide est une espèce chimique capable de céder au moins un proton H+
Une base est une espèce chimique capable de capter au moins un proton H+
Un acide noté AH et sa base conjuguée notée A- forment un couple acide base noté:
AH/A-
Ils sont reliés par une demie équation protonique:
AH=A-+H+
Exemple: acide éthanoique (aussi appellé acide acétique)
CH3CO2H/CH3C02- (ioun éthanoate, aussi appellé acétate)
Certains éléments se comportent à la fois comme un acide et une base: on l'apelle amphotère. L'eau est amphotère.
Elle joue le rôle de base dans le couple:
H3O+ / H2O
Et le rôle d'acide dans le couple:
H2O / OH-
2) Equation de réaction acido-basique
Toute réaction acido basique est un transfert de proton(s) mettant en jeu deux couples.
Si un acide A1H réagit avec une base A2-
A1H / A1-
A2H / A2-
L'équation s'écrira:
A1H + A2- = A1- + A2H
Exemple: l'acide éthanoique réagit avec l'eau:
CH3CO2H / CH3CO2-
H3O+ / H2O
L'équation est donc:
CH3CO2H + H2O = H3O+ + CH3CO2-
II - Définition et mesure du pH d'une solution
1) Définition du pH
Pour des solutions diluées ([H3O+] < 10^-1 mol/L) le pH s'exprime:
Et donc:
Pas besoin de savoir exactement ce qu'est log (logarithme) pour le moment, si vous vous posez la question et que vous ne l'avez pas encore vu en mathématiques, considerez le comme une simple fonction qui permettra de faire ce calcul et retenez juste les deux formules ci dessus 

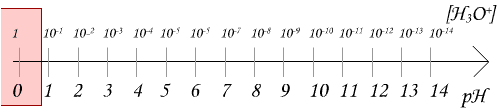
(On ne s'interesse pas aux valeurs en rouge car la formule serait plus compliquée)
Une valeur de pH se mesure généralement à l'aide du papier pH ou du pH-mètre.
2) Précision d'une mesure de pH
Une erreur sur le pH de moins de 1% peut entraîner une erreur de 10% sur la concentration de [H3O+], toute concentration issue d'une mesure de pH devra être exprimée avec au plus deux chiffres significatifs.
III - Etat d'équilibre d'un système chimique
1) Avancement final
Schéma de l'experience d'exemple
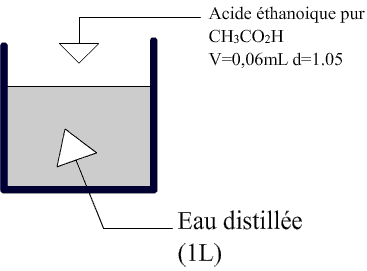
1) Calculs experimentaux
On calcule la quantité de matière initiale:
mA=1.05*0.6=0.63g
MA=12+3+12+32+1=60
Ainsi:
CA=10-2 mol/L
On prelève V'=20 mL de cette solution et on mesure le pH=3.4
On peut donc calculer:
[H3O+]=10-3.4=4.0*10-4
Et
nH3O+=[H3O+]*V'=20*10-3*4*10-4=8*10-6
2) Calculs théoriques
On dresse un tableau d'avancement de la réaction, les couples sont:
CH3CO2H / CH3CO2-
H3O+ / H2O
| CH3CO2H + |
H2O = | CH3CO2- + |
H3O+ | |
| E.I | 2*10-4 | exces | 0 | 0 |
| E.F (Théorique) |
0 | exces | 2*10-4 | 2*10-4 ("Xmax") |
| E.F (Experim.) |
1.9*10-4 | exces | 8*10-6 | 8*10-6 ("Xf") |
Par calcul on a établit que:
niCH3CO2H=20*10-3*10-2=2.10-4mol
L'état final du système est constitué d'une grande quantité d'acide éthanoique n'ayant pas réagitet qui aurait du réagir entièrement si la réaction avait été totale.
Une réaction chimique peut donc être limitée. Dans ce cas, aucun des réactifs n'a totalement disparu lorsque le système cesse d'évoluer.
L'avancement final (expérimental) est inférieur à l'avancemet maximal (théorique).
Xf < Xmax
On utilise dans l'écriture d'une réaction limitée le signe "=" (Et non la flèche)
2) Taux d'avancement final
Le taux d'avancement final se note:
0 < Xf < Xmax, donc τ est compris entre 0 et 1
- Si τ=0, la réaction n'a pas eu lieu
- Si 0<τ<1, la réaction a partiellement eu lieu
- Si τ=1, la réaction est totale
Dans l'exemple τ=0.04, c'est à dire que la réaction a été finie a 4% seulement.
3) Sens d'évolution d'un systeme chimique
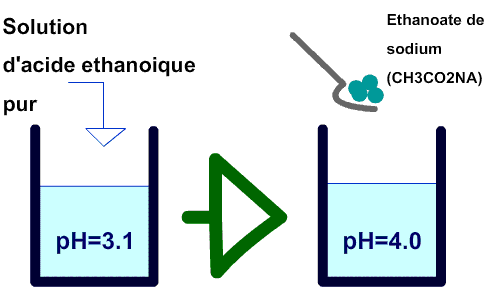
On remarque qu'on retrouve un pH plus élevé après la seconde experience. Donc la concentration en ions H+ a diminué.
La premiere réaction est:
CH3CO2H+H20 = CH3CO2-+H3O+
En fait, une réaction non totale (c'est à dire limitée) peut s'effectuer dans les deux sens (direct/inverse)
-> sens direct
A + B = C + D
<- sens indirect
Il s'agit d'un équilibre chimique traduit par un signe "=" dans l'équation de la réaction.
Du point de vue macroscopique, l'équilibre signifie que les réactifs et les produits coexistent dans des proportions qui n'évoluent plus lorsque l'état d'équilibre (ou final) est atteint
A l'échelle microscopique les chocs entre les molecules de réactifs et de produit sont incessants et égaux (la vitesse de formation de produit est égale à la vitesse de dissparition des réactifs).
On dit que l'équilibre chimique est dynamique
A l'échelle microscopique les chocs entre les molecules de réactifs et de produit sont incessants et égaux (la vitesse de formation de produit est égale à la vitesse de dissparition des réactifs).
On dit que l'équilibre chimique est dynamique
