Equilibres Acido-Basiques
le pH de l'eau pure vaut 7,0
Elle contient des ions oxonium H3O+:
pH=-log([H3O+])
Donc [H3O+]=10-7mol/L
L'eau pure subit une ionisation partielle:

Cette ionisation fournit autant d'ions oxonium que d'ions hydroxyde. A 25°, On prend V=1L d'eau pure. On a donc m=1kg=103g

Si on regarde l'équation, on peut en déduire que l'avancemetn final est donné par H3O+ (pour une mole d'eau on a une mole d'ions oxonium et une mole d'ions hydroxyde.)

Cette réaction est donc limitée. A 25°C, dans l'eau pure, [H3O+]=[OH-]=10-7mol/L
La constante d'équilibre associée à l'équation d'autoprotolyse:

 On met ici un 1 au dénominateur en rapport avec la formule de calcul du quotient d'avancement (produit des concentrations des produits sur le produit des concentrations des réactifs) et parce qu'on ne compte par le solvant ou les quantités en excès.
On met ici un 1 au dénominateur en rapport avec la formule de calcul du quotient d'avancement (produit des concentrations des produits sur le produit des concentrations des réactifs) et parce qu'on ne compte par le solvant ou les quantités en excès.
Ici Ke=10-14
Ke dépends de la température de l'eau.
Ce calcul s'effectue pour toute solution aqueuse
Pour des raisons de commodité d'écriture on utilise souvent le cologarithme qui est en fait une fonction notée p et définie par:
%20=%20-log(x))
=-log(10^{-14})=14)
Pour voir un exemple d'applications vous pouvez cliquer ici:
On considere deux solutions aqueuses A et B et on se propose de calculer leur pH
)
%20+%205%20=4.19)
On passe par Ke:

)
+log(OH^-))
)
=4.7)
 Le résultat pH=pKe+log([OH-]) peut être retenu à titre général
Le résultat pH=pKe+log([OH-]) peut être retenu à titre général
I - Réaction d'auto protolyse de l'eau et produit Ionique
1) Autoprotolyse de l'eau
le pH de l'eau pure vaut 7,0
Elle contient des ions oxonium H3O+:
pH=-log([H3O+])
Donc [H3O+]=10-7mol/L
L'eau pure subit une ionisation partielle:
Cette ionisation fournit autant d'ions oxonium que d'ions hydroxyde. A 25°, On prend V=1L d'eau pure. On a donc m=1kg=103g
2) Avancement final
Si on regarde l'équation, on peut en déduire que l'avancemetn final est donné par H3O+ (pour une mole d'eau on a une mole d'ions oxonium et une mole d'ions hydroxyde.)
Cette réaction est donc limitée. A 25°C, dans l'eau pure, [H3O+]=[OH-]=10-7mol/L
3) Produit ionique de l'eau
La constante d'équilibre associée à l'équation d'autoprotolyse:
 On met ici un 1 au dénominateur en rapport avec la formule de calcul du quotient d'avancement (produit des concentrations des produits sur le produit des concentrations des réactifs) et parce qu'on ne compte par le solvant ou les quantités en excès.
On met ici un 1 au dénominateur en rapport avec la formule de calcul du quotient d'avancement (produit des concentrations des produits sur le produit des concentrations des réactifs) et parce qu'on ne compte par le solvant ou les quantités en excès.Ici Ke=10-14
Ke dépends de la température de l'eau.
Ce calcul s'effectue pour toute solution aqueuse
Pour des raisons de commodité d'écriture on utilise souvent le cologarithme qui est en fait une fonction notée p et définie par:
Pour voir un exemple d'applications vous pouvez cliquer ici:
On considere deux solutions aqueuses A et B et on se propose de calculer leur pH
Solution A:
Donnée: [H3O+]=6.5x10-5mol/LSolution B:
Donnée: [OH-]=5.5x10-10mol/LOn passe par Ke:
 Le résultat pH=pKe+log([OH-]) peut être retenu à titre général
Le résultat pH=pKe+log([OH-]) peut être retenu à titre général4) Solutions neutres, acides et basiques
Solutions neutres ([H3O+]f=[OH-]f)
Ke=[H3O+]² donc log Ke=log([H3O+]²)=2log([H3O+])
Solutions acides ([H3O+]f > [OH-]f)
Ke=[H3O+]f x [OH-]fDonc
[H3O+]f ² > Ke
Solutions Basiquess ([H3O+]f < [OH-]f)
Ke=[H3O+]f x [OH-]fDonc
[H3O+]f ² > Ke
II - Constante d'acidité Ka
1) Définition
On met dans de l'eau l'acide HA. La constante d'équilibre associée à l'équation de cette réaction est apellée constante d'acidité Ka:
 pkA=-log(Ka) et Ka=10-pKa
pkA=-log(Ka) et Ka=10-pKa2) Réactions dans l'eau
H3O+/H2O
La reaction s'écrit:
H3O+ + H2O -> H2O + H3O+
On en déduit:
H2O/OH-
Il s'agit en fait ici de l'autoprotolyse de l'eau:H2O+H2O -> OH- + H3O+
pKa(H2O/OH-)=-log(Ka2)=pKe=14 à 25°C
III - Diagrammes de prédominances
1) Cas général
Les espèces acides A et basiques B d'un couple A/B possèdent des domaines de prédominance différents:
- Lorsque pH=pKa
- Lorsque pH>pKa
- Lorsque pH<pKa
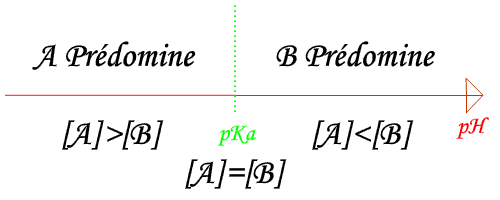
 Le diagramme (ci-dessous) représentant le pourcentage d'un acide A en solution et celui de sa base conjuguée B est appelé diagramme de prédominance
Le diagramme (ci-dessous) représentant le pourcentage d'un acide A en solution et celui de sa base conjuguée B est appelé diagramme de prédominance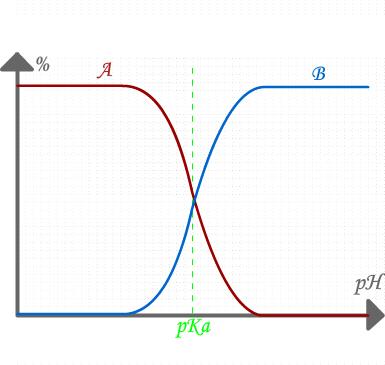
2) Applications des indicateurs colorés
Les indicateurs colorés acido-basiques sont constitués par des couples acide/base dont les espèces acide et base conjuguée ont des teintes différentes.
On considère le couple: HIn/In-
Dont la constante est généralement appellée Kai
La teinte de l'indicateur dépend de l'espèce qui prédomine et donc du pH !
La zone de pH correspondant au changement de prédominance s'apelle zone de virage d'un indicateur coloré.